When we think of ocean giants we usually think of whales, which indeed include the largest animal known to have lived in our planet, the blue whale (Balaenoptera musculus) reaching lengths of up to 29 meters (95 feet). Things were not so different during the Mesozoic, the so-called 'Age of Dinosaurs', when the oceans had various groups of large marine tetrapods, mainly ichthyosaurs, pliosaurs and mosasaurs. Amongst these different groups of Mesozoic marine reptiles, ichthyosaurs hold the record for the largest to have swam in the Mesozoic seas. Now, in my most recent paper published yesterday in Science, we describe the first giant ichthyosaur, which also turned out to be the first giant vertebrate in Earth's history. The new species, named Cymbospondylus youngorum, was discovered in Middle Triassic (~242-247 million years ago) deposits in central Nevada and is part of an icthyosaur-rich fauna (AKA Fossil Hill Fauna) that includes at least seven other species of ichthyosaurs and the pistosauroid Augustasaurus hagdorni (Leidy, 1868; Merriam, 1906, 1910; Sander et al., 1997; Schmitz et al., 2004; Fröbisch et al., 2006; Fröbisch et al., 2013; Klein et al., 2020; Sander et al., 2021).
 |
| Life reconstruction of Cymbospondylus youngorum by my very talented colleague Stephanie Abramowicz (you should check out her other work here). |
 |
| The holotype of Shonisaurus sikanniensis, seen on a recent visit to the Royal Tyrrell Museum in Alberta, Canada. |
The Fossil Hill Fauna represents the most diverse ichthyosaur assemblage known, with species ranging from 2 to 17 meters. Interestingly, this is taking place about 246 million years ago, a mere six million years after the Permo-Triassic extinction, when about 90% of organism in our planet became extinct, and 3 million years after the appearance of the first ichthyosaurs. This suggest a speedy recovery for life in the oceans, and very fast diversification and body size increase in ichthyosaurs, and made us wonder about the structure and trophic interactions in this ancient ecosystem.
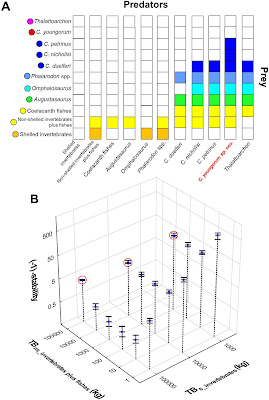
Besides the marine tetrapods, the Fossil Hill Fauna includes fishes, conodonts, ammonoids and most likely coleoids (shell-less cephalopods). One of the big questions with regards to this ancient ecosystem was, how sustainable was this predator-rich environment in the absence of modern primary producers? To answer this we explored energy flux models by estimating body masses, number of individuals and energy requirements for the Fossil Hill Fauna to test food web stability.
The short answer is yes, the Fossil Hill Fauna was stable, even if taking the ammonites as the sole primary producers. More interestingly, our results suggest that this fauna could still sustain additional marine tetrapods, including a hypothetical filter or bulk feeding ichthyosaur!
Our other big analysis was to compare body size evolution in ichthyosaurs and whales. For this we used time-calibrated phylogenies and body size datasets for both groups to explore body size evolution over time in these two, somewhat similar, groups of secondarily aquatic tetrapods. The big takeaway from our analysis is that ichthyosaurs got really big, really early in their evolutionary history, at a rate unmatched by cetaceans which got big at slower rates. Body size increases occurred multiple times in both groups, and we also detected body size decreases in some cetacean lineages, such as kogiids (pygmy and dwarf sperm whales and their extinct relatives).
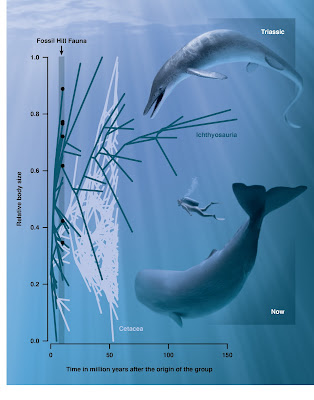 |
| Comparison of body size evolution in ichthyosaurs vs cetaceans. The 'Y' axis shows relative body size (greater towards the top) and the 'X' axis is time since the origin of the different groups. |
 |
| From left to right: myself with a cast of a Minke whale (Balaenoptera acutorostrata) skull, Tom Young and lead author Martin Sander (University of Bonn) with a cast of the skull of Cymbospondylus youngorum. The specific epithet of the new species is after Tom and his wife Bonda owners of Great Basin Brewing Co., and supporters of Martin's work in Nevada. |
As researcher we often compare ichthyosaurs and cetaceans, so this project was extremely satisfying as we were able to really dive into some of the overlapping aspects of their evolutionary history. Our approach combined traditional paleontological methods with computational modeling bringing together a group of experts in different fields which allowed us to explore macroevolutionary patterns in these groups. While our results are very exciting, this work is a stepping stone as there is still a lot to understand about ancient marine ecosystems and body size evolution across other groups of secondarily aquatic tetrapods.
Literature Cited
Fröbisch, N. B., P. M. Sander, and O. Rieppel. 2006. A new species of Cymbospondylus (Diapsida, Ichthyosauria) from the Middle Triassic of Nevada and a re-evaluation of the skull osteology of the genus. Zoological Journal of the Linnean Society 147:515–538.
Fröbisch, N. B., J. Fröbisch, P. M. Sander, L. Schmitz, and O. Rieppel. 2013. Macropredatory ichthyosaur from the Middle Triassic and the origin of modern trophic networks. Proceedings of the National Academy of Sciences 110(4):1393–1397.
Klein, N., L. Schmitz, T. Wintrich, and P. M. Sander. 2020. A new cymbospondylid ichthyosaur (Ichthyosauria) from the Middle Triassic (Anisian) of the Augusta Mountains, Nevada, USA. Journal of Systematic Palaeontology 18(14):1167–1191.
Leidy, J. 1868. Notice of some reptilian remains from Nevada. Proceedings of the Philadelphia Academy of Sciences 20:177–178.
Lomax, D. R., P. De la Salle, J. A. Massare, and R. Gallois. 2018. A giant late Triassic ichthyosaur from the UK and a reinterpretation of the Aust Cliff 'dinosaurian' bones. PLoS ONE 13(4):e0194742.
Merriam, J. C. 1906. Preliminary note on a new marine reptile from the Middle Triassic of Nevada. University of California Publications–Bulletin of the Department of Geology 5:5–79.
Merriam, J. C. 1910. The skull and dentition of a primitive ichthyosaurian from the Middle Triassic. University of California Publications–Bulletin of the Department of Geology 5:381–390.
Nicholls, E. L., and M. Manabe. 2004. Giant ichthyosaurs of the Triassic—a new species of Shonisaurus from the Pardonet Formation (Norian:late Triassic) of British Columbia. Journal of Vertebrate Paleontology 24:838–849.
Sander, P. M., O. C. Rieppel, and H. Bucher. 1997. A new pistosaurid (Reptilia:Sauropterygia) from the Middle Triassic of Nevada and its implications for the origin of the plesiosaurs. Journal of Vertebrate Paleontology 17(3):526–533.
Sander, P. M., E. M. Griebeler, N. Klein, J. Velez-Juarbe, T. Wintrich, L. J. Revell, and L. Schmitz. 2021. Early giant reveals faster evolution of large size in ichthyosaurs than in cetaceans. Science 374:eabf5787.
Schmitz, L., P. M. Sander, G. W. Storrs, and O. Rieppel. 2004. New Mixosauridae (Ichthyosauria) from the Middle Triassic of the Augusta Mountains (Nevada, USA) and their implications for mixosaur taxonomy. Palaeontographica Abt. A 270:133–162.
Slater, G. J., J. A. Goldbogen, and N. D. Pyenson. 2017. Independent evolution of baleen whale gigantism linked to Plio-Pleistocene ocean dynamics. Proceedings of the Royal Society B 284:20170546.