Esta semana ha salido una nueva publicación en el Journal of Mammalian Evolution donde junto con un nutrido grupo de colegas describimos la microestructura del esmalte de los incisivos de los roedores caviomorfos caribeños (Marivaux et al., 2022). Los lectores habituales de este blog recordarán que el tema de los roedores caribeños es uno que tocamos con cierta frecuencia, desde las diversas entradas sobre los roedores más antiguos de la región (Partes 1, 2 y 3) hasta un resumen de las diversas especies que han existido en Puerto Rico. Para los que quizás no estén tan familiarizados o necesiten un resumen, les daré un poco de contexto el cual también servirá para entender parte de los motivos detrás del nuevo estudio.
 |
| Mapa de distribución de especies actuales de jutías (modificado de Fabre et al., 2014). |
Actualmente en las Antillas existe un grupo de roedores endémicos pertenecientes a la subfamilia Capromyinae, coloquialmente conocidos como jutías. Aunque actualmente hay alrededor de 13 especies (ver mapa arriba), en el pasado, particularmente durante el periodo Cuaternario existían muchas más y gozaban de una distribución más amplia (Woods et al., 2001; Fabre et al., 2014; Courcelle et al., 2019). En adición a esto, existía dos grupos adicionales de roedores caviomorfos endémicos, los Heteropsomyinae y los "Heptaxodontidae" o "jutías gigantes" (Woods et al., 2001; MacPhee, 2009; Upham, 2017). Los Capromyinae y Heteropsomyinae son parte de una radiación endémica de "ratas espinosas" antillanas (Echimyidae), que aparecen en la región por primera vez en el Mioceno temprano de Cuba, representados por la especie Zazamys veronicae (MacPhee & Iturralde-Vinent, 1995). Sin embargo, la relación entre las "jutías gigantes" y otros grupos de roedores caviomorfos ha sido un tema de debate por mucho tiempo, resultando en distintas hipótesis sobre cuales son sus parientes actuales más cercanos (ver resumen en MacPhee, 2011).
Para añadirle a el tema de las "jutías gigantes", en 2020 describimos dos especies de roedores del Oligoceno temprano de Puerto Rico, Borikenomys praecursor y una segunda especie, parecida a Borikenomys, pero más grande (Marivaux et al., 2020). Los resultados del análisis filogenético de ese trabajo sugieren un parentesco entre Borikenomys y Elasmodontomys obliquus ambas especies a su vez cerca a la familia Dinomyidae y con Amblyrhiza inundata en una posición más basal, pero todos dentro del grupo conocido como Chinchilloidea. Mientras que los Capromyinae y Heteropsomyinae son parte de la familia Echimyidae en el grupo Octodontoidea. Elasmodontomys y Amblyrhiza son dos de las especies tradicionalmente clasificadas como parte de Heptaxodontidae ("jutías gigantes"). Por lo cual, nuestros resultado sugieren que Borikenomys y algunas de las "jutías gigantes" posiblemente representan una radiación endémica de Chinchilloidea que llegaron a la región a finales del Eoceno, hace unos 33 millones de años atrás. No obstante, el deseo de utilizar todas las fuentes de información morfológicas posibles nos llevó al trabajo que recién publicamos.
Para tratar de entender mejor las relaciones entre las distintas especies de roedores endémicos caribeños nos dimos la tarea de analizar la microestructura del esmalte de los dientes incisivos de los Capromyinae, Heteropsomyinae, Heptaxodontidae y Borikenomys (Marivaux et al., 2022). Este tipo de análisis requiere que los incisivos se corten longitudinalmente para luego examinar esa superficie utilizando un microscopio electrónico de barrido (scanning electron microscope), para así observar los detalles de la microestructura de la parte interna del esmalte.
 |
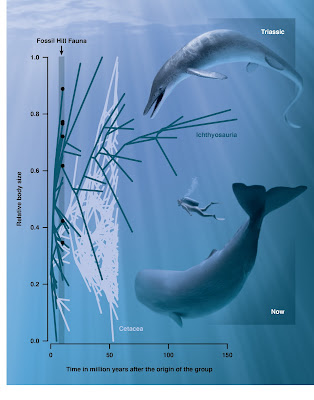
| Aquí se observa un incisivo cortado longitudinalmente y las zonas y subzonas del esmalte que se examinan en detalle a diferentes aumentos. Tomado de Marivaux et al. (2022). |
Para que nuestro trabajo fuera lo más completo posible, utilizamos especímenes de varias colecciones para así tener representantes de la mayor cantidad de especies de roedores caviomorfos caribeños (actuales y extintos) como fuera posible, con un total de 18 especies. Decidimos estudiar la microestructura del esmalte ya que la misma tiene lo que nos referimos como señal filogenética. En otras palabras, la microestructura de los incisivos de roedores tiene una morfología específica y distintiva para cada grupo y nos puede dar una buena idea respecto a qué grupo pertenecen los especímenes que se están examinando. Esta es una herramienta muy útil, especialmente en casos donde se requiere información adicional o cuando solamente encontramos incisivos y no hay otros dientes. Y esto fue el caso en un trabajo previo, del 2014, donde haciendo este tipo de análisis logramos demostrar que los roedores caviomorfos ya estaban en las Antillas para el Oligoceno temprano (aquí hay más detalles sobre ese trabajo).
Los caviomorfos presentan varios tipos de organización de los cristales de hidroxiapatita que conforman la parte interna del esmalte de los dientes. Los primeros dos tipos se clasifican como Sbt. 1 y Sbt. 2 incluyendo una etapa transicional que se le conoce como Sbt. 1-2. Estos tipos son los más plesiomórficos (o primitivos), mientras que el tercero, Sbt. 3 es el más derivado o avanzado y es el arreglo con mayor resistencia estructural. Entre los roedores caviomorfos los tipos Sbt. 1 y 2 se ven en tres grupos: Erethizontoidea (e.g. coendúes y puercoespines), Cavioidea (e.g. capibaras y agutíes) y Chinchilloidea (e.g. pacaranas y chinchillas); mientras que el Sbt. 3 es exclusivo de los Octodontoidea (e.g. jutías y ratas espinosas). Cada tipo de microestructura de esmalte aparece muy temprano durante la historia evolutiva de cada grupo, prácticamente, cada grupo ya está diferenciado desde el Eoceno-Oligoceno (Martin, 2004, 2005; Boivin et al., 2019).
Los resultados de nuestro estudio muestran que los Capromyinae (e.g. Isolobodon portoricensis y Capromys pilorides) y los Heteropsomyinae (e.g. Boromys torrei), tienen microestructura de esmalte tipo Sbt. 3 (ver figura abajo). Esto es consistente con su clasificación dentro de Octodontoidea y con resultados de otros estudios morfológicos y moleculares.
Mientras tanto, en los "Heptaxodontidae" la microestructura del esmalte observada es de los tipos Sbt.1 en Clidomys sp., y Sbt. 1-2 (intermedio) en Elasmodontomys obliquus y Amblyrhiza sp., el cual también ocurre en Borikenomys praecursor (ver figura abajo). Esta morfología, junto con la de sus molares, sugiere que estas especies están emparentadas y pertenecen dentro de Chinchilloidea, lo cual es congruente con el análisis filogenético que publicamos hace unos años (Marivaux et al., 2020). Adicionalmente, Clidomys y Amblyrhiza también comparten características de la región auditiva con otros Chinchilloidea.
Sin embargo, estos resultados contrastan con los de un estudio de ADN antiguo (ADNa) donde sugieren que Elasmodontomys es un Capromyinae (Woods et al., 2021), lo cual implicaría que las complejas características dentales compartidas entre Borikenomys, Clidomys, Elasmodontomys y Amblyrhiza evolucionaron convergentemente. Implica además que en Elasmodontomys ocurrió una reversión evolutiva en la microestructura de los incisivos, de tener un antepasado con Sbt. 3 a tener la versión más plesiomórfica y estructuralmente menos estable de Sbt. 1-2. Esto difiere del patrón general que se observa en los Octodontoidea (incluyendo Capromyinae), los cuales presentan microestructura tipo Sbt. 3 desde finales del Eoceno y sería un tipo de reversión evolutiva sin precedente, ya que la presión selectiva es a reenforzar los incisivos, no a debilitarlos.
Otra alternativa a esta discrepancia entre resultados morfológicos y moleculares es que sea el resultado de un error de muestreo en el estudio de Woods et al. (2021). La probabilidad de esto se debe a que los restos de Elasmodontomys se encuentran frecuentemente en la misma localidad que los de Heteropsomys (e.g. McFarlane, 1999; Vélez-Juarbe & Miller, 2007), e incluso Isolobodon (pers. obs.). Partiendo de esto, la mejor forma de resolverlo será extraer ADNa de restos que sin duda sean de Elasmodontomys (e idealmente otras especies de "jutías gigantes"). También hay que concentrar esfuerzos de campo para encontrar fósiles que ayuden a completar el registro fósil de los roedores caviomorfos caribeños.
Courcelle, M., M.-K. Tilak, Y. L. R. Leite, E. J. P. Douzery, and P.-H. Fabre. 2019. Digging for the spiny rat and hutia phylogeny using a gene capture approach, with the description of a new mammal subfamily. Molecular Phylogenetics and Evolution 136:241–253.
Fabre, P.-H., J. T. Vilstrup, M. Raghavan, C. Der Sarkissian, E. Willerslev, E. J. P. Douzery, and L. Orlando. 2014. Rodents of the Caribbean: origin and diversification of hutias unravelled by next-generation museomics. Biology Letters 10:20140266.
MacPhee, R. D. E. 2009. Insulae infortunatae: establishing a chronology for Late Quaternary mammal extinctions in the West Indies. In: Haynes, G. (ed.) American Megafaunal Extinctions at the End of the Pleistocene. Springer, Dordrecht, pp. 169–193.
MacPhee, R. D. E. 2011. Basicranial morphology and relationships of Antillean Heptaxodontidae (Rodentia, Ctenohystrica, Caviomorpha). Bulletin of the American Museum of Natural History 363:1–70.
MacPhee, R. D. E. and M. A. Iturralde-Vinent. 1995. Origin of the Greater Antillean land mammal fauna, 1: new Tertiary fossils from Cuba and Puerto Rico. American Museum Novitates 3141:1–30.
Marivaux, L., L. W. Viñola-López, M. Boivin, L. Da Cunha, P.-H. Fabre, R. Joannes-Boyau, G. Maincent, P. Münch, N. S. Stutz, J. Vélez-Juarbe, and P.-O. Antoine. 2022. Incisor enamel microstructure of West Indian caviomorph hystricognathous rodents (Octodontoidea and Chinchilloidea). Journal of Mammalian Evolution. DOI: 10.1007/s10914-022-09631-7
Marivaux, L., J. Vélez-Juarbe, G. Merzeraud, F. Pujos, L. W. Viñola López, M. Boivin, H. Santos-Mercado, E. J. Cruz, A. Grajales, J. Padilla, K. I. Vélez-Rosado, M. Philippon, J.-L. Léticée, P. Münch, and P.-O. Antoine. 2020. Early Oligocene chinchilloid caviomorphs from Puerto Rico and the initial rodent colonization of the West Indies. Proceedings of the Royal Society B 287:20192806.
Martin, T. 2004. Incisor enamel microstructure of South America's earliest rodents: implication for caviomorph origin and diversification. In: Campbell, K. E. (ed.) The Paleogene Mammalian Fauna of Santa Rosa, Amazonian Peru. Natural History Museum of Los Angeles County Science Series 40:131–140.
Martin, T. 2005. Incisor enamel schmelzmuster diversity in South America's oldest rodent fauna and early caviomorph history. Journal of Mammalian Evolution 12:405–417.
McFarlane, D. E. 1999. Late Quaternary fossil mammals and last occurrence dates from caves at Barahona, Puerto Rico. Caribbean Journal of Science 35:238–248.
Upham, N. S. 2017. Past and present of insular Caribbean mammals: understanding Holocene extinctions to inform modern biodiversity conservation. Journal of Mammalogy 98:913–917.
Vélez-Juarbe, J., and T. E. Miller. 2007. First report of a Quaternary crocodylian from a cave deposit in northern Puerto Rico. Caribbean Journal of Science 43:273–277.
Vélez-Juarbe, J., T. Martin, R. D. E. MacPhee, and D. Ortega-Ariza. 2014. The earliest Caribbean rodents: Oligocene caviomorphs from Puerto Rico. Journal of Vertebrate Paleontology 34:157–163.
Woods, C. A., R. Borroto-Páez, and C. W. Kilpatrick. 2001. Insular patterns and radiations of West Indian rodents. In: Woods, C. A., & Sergile, F. E. (eds.) Biogeography of the West Indies: Patterns and Perspectives. CRC Press, Boca Raton, pp. 335–353.
Woods, R., I. Barnes, S. Brace, and S. T. Turvey. 2021. Ancient DNA suggests single colonisation and within-archipelago diversification of Caribbean caviomorph rodents. Molecular Biology and Evolution 38:84–95.